
- Autor Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:35.
- Viimati modifitseeritud 2025-01-22 16:57.
Kloor isotoop 18 neutroniga on arvukus 0,7577 ja massiarv 35 amu. Et arvutada keskmine aatommass, korrutage murdosa igaühe massinumbriga isotoop , seejärel lisage need kokku.
Samamoodi, milline on elemendi kõigi isotoopide kaalutud keskmine?
Erinevate masside kasutamine isotoobid ja kui rikkalik on igaüks neist isotoop on, me leiame keskmine an aatomite mass element . An aatommass element on kaalutud keskmine aatomite mass looduslikult esinevas proovis element . Aatommass esitatakse tavaliselt aatommassi ühikutes.
mille mass on 1 amu? Aatommassi ühik (sümboliseeritud AMU või amu) on määratletud kui täpselt 1/12 süsiniku-12 aatomi massist. Süsinik-12 (C-12) aatomil on kuus prootonid ja kuus neutronid selle tuumas. Ebatäpselt öeldes on üks AMU keskmine prooton puhkemass ja neutron puhkemass.
Teiseks, kuidas arvutada aatommassi abil arvukuse protsenti?
Muutke iga arvukuse protsenti kümnendkoha kujul, jagades 100-ga. Korrutage see väärtus arvuga aatommass sellest isotoobist. Keskmise saamiseks liitke iga isotoobi kohta kokku aatommass.
Mis vahe on aatommassil ja aatommassil?
Aatommass (ma) on mass an aatom . Üksik aatom on määratud arv prootoneid ja neutroneid, nii et mass on ühemõtteline (ei muutu) ja on prootonite ja neutronite arvu summa aatomis . Aatomi kaal on kaalutud keskmine mass kõigist aatomid isotoopide arvukuse alusel.
Soovitan:
Kuidas leida kahe kiirusega keskmine kiirus?
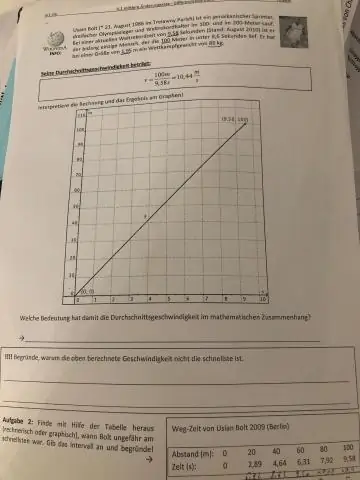
Keskmise leidmiseks jagatakse alg- ja lõppkiiruse summa 2-ga. Keskmise kiiruse kalkulaator kasutab valemit, mis näitab, et keskmine kiirus (v) võrdub lõppkiiruse (v) ja algkiiruse (u) summaga, jagatud 2-ga
Kuidas te kaalutud tähendust tõlgendate?

Kokkuvõte. Kaalutud keskmine: keskmine, mille puhul mõned väärtused annavad rohkem panuse kui teised. Kui kaalud liidetakse ühega: lihtsalt korrutage iga kaal vastava väärtusega ja summeerige see kõik. Vastasel juhul korrutage iga kaal w vastava väärtusega x, summeerige see kõik ja jagage kaalude summaga: Kaalutud keskmine = ΣwxΣw
Kuidas leida keskmine vaba tee?

Keskmine vaba tee on vahemaa, mille molekul läbib kokkupõrgete vahel. Keskmine vaba tee määratakse kriteeriumiga, et põrketoru sees on üks molekul, mille molekulaarne trajektoor eemaldab. Kriteerium on: λ (N/V) π r2 ≈ 1, kus r on molekuli raadius
Mis on kaalutud keskmine mass?

Elemendi aatommass on elemendi isotoopide masside kaalutud keskmine. Elemendi aatommassi saab arvutada, kui on teada elemendi looduslikult esinevate isotoopide suhteline arvukus ja nende isotoopide mass
Kuidas leida kiiruse ja aja graafikul keskmine kiirus?

Kiiruse/aja kõvera alune pindala on kogu nihe. Kui jagate selle aja muutusega, saate keskmise kiiruse. Kiirus on kiiruse vektorvorm. Kui kiirus on alati mittenegatiivne, on keskmine kiirus ja keskmine kiirus samad
