
- Autor Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:35.
- Viimati modifitseeritud 2025-01-22 16:57.
Ca( OH)2 on ioonne ühend, milles Ca on katioon ja OH on anioon. Ca (kaltsium) sisaldab a tasu 2+, kuna see on perioodilisuse tabeli 2. rühmas. OH (hüdroksiid) on polüatomiline ioon, mille a tasu -1-st.
Samamoodi võib küsida, mis on AS-i laeng?
Ühiste elementide tasude tabel
| Number | Element | Lae |
|---|---|---|
| 30 | tsink | 2+ |
| 31 | gallium | 3+ |
| 32 | germaanium | 4-, 2+, 4+ |
| 33 | arseen | 3-, 3+, 5+ |
Seejärel tekib küsimus, kuidas teate polüaatomilise iooni laengut? Arvutama oksüdatsiooniarvust Hapniku oksüdatsiooniarv on -2 ja vesiniku oksüdatsiooniarv on +1. Liidage kokku kõigi aatomite oksüdatsiooninumbrid polüatomiline ioon . Näites -2 +1 = -1. See on tasu peal polüatomiline ioon.
mis on OH 2 laeng?
Ca( Oh ) 2 on ioonne ühend, milles Ca on katioon ja Oh on anioon. Ca (kaltsium) sisaldab a tasu kohta 2 +, kuna see on rühmas 2 perioodilisuse tabelis. Oh (hüdroksiid) on polüaatomiline ioon, mille a tasu -1-st.
Mis on MG süüdistus?
Lõpptulemusena on +2 tasu magneesiumioonil, kuna seal on a tasu 2 elektroni koguse erinevust, kuid nii, et oleks suurem positiivne tasu.
Soovitan:
Mis on hüdrooniumiooni laeng?

Hüdroniumiooni laeng on +1. Selle keemiline valem on H3O+. Hüdrooniumioonid tekivad happe reageerimisel veega
Mis on elektrone omandava aatomi laeng?
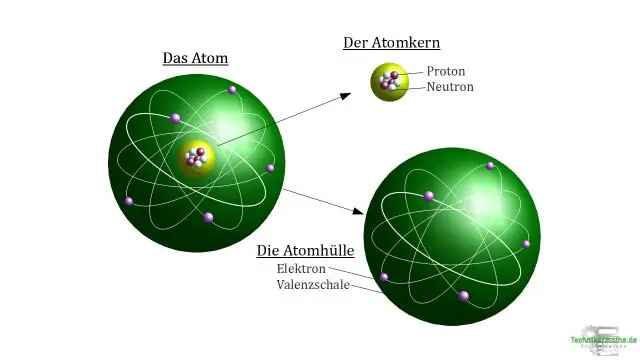
Ioon on aatom, mis on saanud või kaotanud ühe või mitu elektroni ja millel on seetõttu negatiivne või positiivne laeng. Katioon on aatom, mis on kaotanud valentselektroni ja millel on seetõttu rohkem positiivseid prootoneid kui negatiivsetel elektronidel, seega on see positiivselt laetud
Mis on baariumi laeng?

Baariumiooni laeng on 2+, mis tähendab, et sellel on positiivne laeng kaks. Baariumion saab laengu, kaotades kaks elektroni muutumiseks
Mis on suhteline mass ja laeng?

Prootoni suhteline mass on 1 ja osakesel, mille suhteline mass on väiksem kui 1, on mass väiksem. Kuna tuum sisaldab prootoneid ja neutroneid, on suurem osa aatomi massist koondunud selle tuumasse. Prootonitel ja elektronidel on vastupidised elektrilaengud
Mis on seleniidiiooni laeng?

Vastus ja selgitus: elemendil oleks lihtsam muutuda stabiilseks, kui võtaks vastu 2 elektroni, mitte loovutaks 6 elektroni. See viitab sellele, et seleeniooni laeng peab ioonse sideme saamiseks olema & miinus 2. Seetõttu on ioonide laeng, mille seleen ioonühendis moodustab, &miinus 2
