
- Autor Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:35.
- Viimati modifitseeritud 2025-06-01 05:04.
Jätkates teemaga lämmastik , täheldame, et punktis a lämmastik aatomil on kolm sidepaari ja sellel on üks üksik paar ja kokku 5 valentselektroni. The ametlik süüdistus peal lämmastik aatom on seega 5 - (2 + 6/2) = 0. Punktis (b) on lämmastik aatomil on a ametlik süüdistus -1-st.
Samuti, mis on lämmastiku formaalne laeng?
Valentselektronid lämmastik selle ühendites on kõik sp³ hübridiseeritud orbitaalid. The ametlik süüdistus peal N on aniooni puhul tavaliselt -1, neutraalse ühendi puhul 0 ja katioonide puhul +1. A lämmastik aatom koos a ametlik süüdistus -3 vastaks nitriidioonile N32, mis on vesilahuses tugevalt aluseline.
Samamoodi, kuidas arvutate ametlikku tasu? Ametlik tasu = [# valentselektroni neutraalaatomil] - [(# üksikut elektronpaari) + (½ # sideelektroni)] Valentselektronid = vastab perioodilisuse tabeli rühmanumbrile (esinduselementide puhul). Üksikud paarid = üksikud elektronid, mis istuvad aatomil. Iga elektron loeb kui üks ja nii paar loeb kahena.
Samuti on teada, milline on lämmastiku formaalne laeng esitatud pildil?
Klõpsake ükskõik kummal pilt optimeeritud geomeetria nägemiseks. The lämmastik aatomil on vesinikuga neli sidet, mis annab lämmastik aatomis kokku 4 valentselektroni. Aatomiline lämmastik on 5 valentselektroni ja seega (5-4) = +1 ja see on õigesti märgistatud kui a ametlik süüdistus +1-st.
Kas hapnik on positiivne või negatiivne?
Hea näide on hapnikuaatom, mis jagab ühte elektroni kahe läheduses oleva elektroniga vesiniku aatomid , moodustades vee H2O molekuli. Hapnikuaatom, mis on edukalt loovutanud ühe või kaks elektroni või jagab ühte või kahte elektroni, on kaotanud osa oma negatiivsest laengust, seega jääb see positiivselt laetuks.
Soovitan:
Milline on lämmastiku tuumavalentselektronide konfiguratsioon?
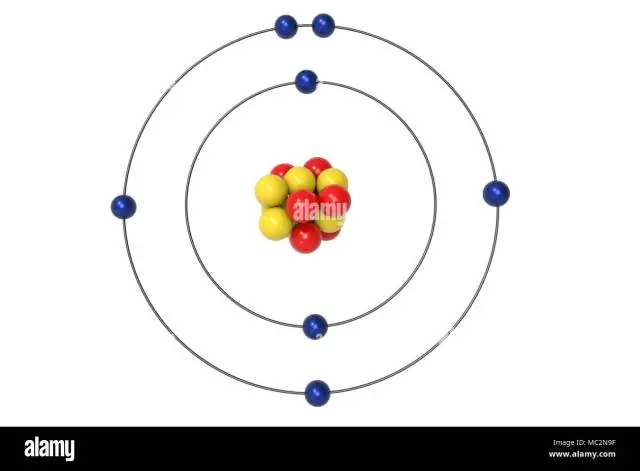
Ülejäänud kolm elektroni lähevad 2p orbitaalile. Seetõttu on N elektroni konfiguratsioon 1s22s22p3. Lämmastiku (N) konfiguratsiooni tähis võimaldab teadlastel hõlpsasti kirjutada ja suhelda, kuidas elektronid on paigutatud lämmastikuaatomi tuuma ümber
Mis tüüpi endomükorriisad on Glomeromycetes'il ja mis on selles erilist?
Glomeromütseedid moodustavad mükoriisa. Sellest hoolimata on nad majanduslikult oluline rühm. Kõik glomeromütseedid moodustavad sümbiootilise mükoriisa koos taimejuurtega. Mükoriisa seened võivad taimedesse viia fosfaadiioone ja muid mineraale. Vastutasuks varustavad taimed seeni orgaaniliste toitainetega
Mida joon Lewise struktuuris tähendab?

Definitsioon. Lewise struktuur on molekuli struktuurne kujutis, kus punkte kasutatakse elektronide positsioonide näitamiseks aatomite ümber ja jooned või punktipaarid tähistavad kovalentseid sidemeid aatomite vahel. Ioonses sidemes on see pigem selline, et üks aatom loovutab elektroni teisele aatomile
Milline on katoodi laeng elektrokeemilises elemendis?

Toiteallika vool surub elektronid diagrammi paremal asuvale elektroodile, kus need põhjustavad liikide vähenemist - seega on see elektrood katood. Elektrolüütilistes elementides on katood negatiivselt laetud. Välise toiteallika abil surutakse elektronid katoodile
Milline on komplementaarse DNA ahela lämmastiku aluste järjestus?

Neli lämmastikualust, mis moodustavad DNA selgroo, paarituvad komplementaarsete aluspaaridega nagu adeniini paarid tümiiniga, tsütosiin aga guaniiniga
