
- Autor Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:35.
- Viimati modifitseeritud 2025-01-22 16:57.
Sellel on kaks põhjust: anda lahusele vesinikuioonid selle hapestamiseks. Teatud redoks (nagu permanganaat) on parem oksüdatsioon võimalused, kui seda teostatakse happeline keskkond. Sulfaadi ioon on tavaliselt raskesti oksüdeeritav ioon redoks-tiitrimised , nii et te tavaliselt kõrvalsaadusi ei saa.
Miks tiitritakse sel viisil happelises keskkonnas?
Väävelhape Hape (H2SO4) kasutatakse redoks tiitrimine protsessi, kuna see annab H(+) ioone, mis on vajalikud reaktsiooni kiiremaks toimumiseks, samas kui sulfaat(-) ioonid reageerivad reaktsiooni ajal vaevu. Seetõttu väävel hape on lisatud, et teha lahus happeline.
Tea ka, miks kasutatakse redoks-tiitrimisel HCL-i asemel väävelhapet? Lahjendatuna väävelhape sobib ideaalselt redoks-tiitrimine sest see ei ole ei oksüdeeriv ega redutseerija. HCL olles tugev elektrolüüt, dissotsieerub vees H+ ja Cl- ioone. Seega on teatud kogus KMnO4 kasutatud üles oksüdeerivas Cl- Cl2-ks. Kõrvuti oksüdeerib KMnO4 oksalaatiooni CO2-ks.
Teiseks, miks pole redoks-tiitrimisel indikaatorit vaja?
Selles katses on see mitte hädavajalik kasutada an indikaator . Seda seetõttu, et ilma pH muutuseta saab reaktsiooni lõpp-punkti määrata ainult värvimuutuse järgi. Samuti saame määrata elektripotentsiaali näitamiseks voltmeetri abil. Lõpp-punkti saab tuvastada voltmeetriga.
Miks KMnO4 kasutatakse happelises keskkonnas?
Seega näete selle oksüdeerivat toimet KMnO4 on maksimaalne happeline keskkond ja kõige vähem põhiosas keskmine nagu happeline keskkond Mn oksüdatsiooniastme vähenemine on maksimaalne, samas kui aluselises on see kõige vähem keskmine . Seega happeline keskkond on kasutatud kui soovite tugevat oksüdatsiooni ja aluselist, kui on vaja väga kerget oksüdatsiooni.
Soovitan:
Mis on standardtemperatuur ja -rõhk Miks on standard vajalik?

Standardsed võrdlustingimused on olulised vedeliku voolukiiruse ning vedelike ja gaaside mahtude väljendamiseks, mis sõltuvad suuresti temperatuurist ja rõhust. STP-d kasutatakse tavaliselt siis, kui arvutustes rakendatakse standardseid olekutingimusi
Miks on Sahara kõrb ekstreemne keskkond?

Sahara kõrbe kõrgete temperatuuride ja kuivade tingimuste tõttu on Sahara kõrbe taimestik hõre ja hõlmab vaid umbes 500 liiki. Need koosnevad peamiselt põua- ja kuumakindlatest sortidest ning soolastele tingimustele kohandatud sortidest (halofüüdid), kus on piisavalt niiskust
Miks on tähtedevaheline keskkond oluline?

Tähtedevaheline keskkond on tähtedega tihedalt läbi põimunud. Tähed tekivad gaasi ja tolmu kokkuvarisemisel molekulaarpilvedes. Äsja moodustunud massiivsete tähtede ümber jääv gaas moodustab HII piirkonnad. Seetõttu mängib tähtedevaheline keskkond galaktika keemilises evolutsioonis olulist rolli
Miks on transkriptsioon valkude sünteesis vajalik samm?
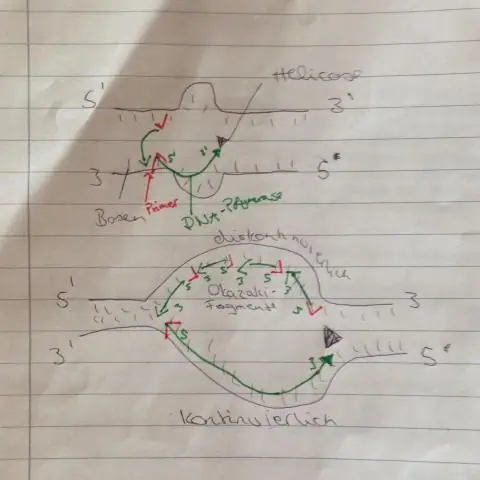
Valkude sünteesi kunst Eukarüootsetes rakkudes toimub transkriptsioon tuumas. Transkriptsiooni ajal kasutatakse DNA-d matriitsina sõnumitooja RNA (mRNA) molekuli valmistamiseks. Translatsiooni ajal loetakse mRNA geneetiline kood ja seda kasutatakse valgu valmistamiseks
Miks on liikumiseks vajalik hõõrdumine?

Kuna hõõrdumine on takistusjõud, mis aeglustab või takistab liikumist, on see vajalik paljudes rakendustes, kus võib tekkida vajadus hoida esemeid või teha asju ning vältida libisemist või libisemist. Ilma hõõrdumiseta ei saaks te kõndida, autot juhtida ega esemeid käes hoida
