
- Autor Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:35.
- Viimati modifitseeritud 2025-06-01 05:04.
Termiline lagunemine
Millal kuumutatud üle 840 °C, kaltsiumkarbonaat laguneb, eraldub gaas süsinikdioksiid ja maha jättes kaltsiumoksiid - a valge tahke aine . Kaltsiumoksiid on tuntud kui lubi ja on üks kümnest parimast kemikaalist, mida toodetakse igal aastal lubjakivi termilisel lagunemisel.
Samamoodi, kui kaltsiumkarbonaati kuumutatakse, kas see laguneb, moodustades kaltsiumoksiidi ja süsinikdioksiidi?
1 vastus. Kaltsiumkarbonaat tahe lagunevad süsinikdioksiidiks ja kaltsiumoksiid . Karbonaat ühendid lagunema millal kuumutatud . Kaltsiumkarbonaat on suhe 1:1, sest kaltsiumi vormid +2 ioon ja karbonaat on -2 laadimisega.
Samamoodi, kas CaCO3 CaO co2 on redoksreaktsioon? Vastus ja selgitus: Ei, CaCO3 → CaO + CO2 ei ole a redoksreaktsioonid . Me teame seda, kontrollides erinevate elementide oksüdatsiooninumbreid reaktsioon läheb
Samuti, mis tüüpi keemiline reaktsioon on CaCO3 CaO co2?
LAGUNEMINE : AB → A + B Näited: 2 H2O → 2 H2 + O2 CaCO3 → CaO + CO2 Lagunemine on üldiselt vastupidine (tagurpidine) kombineeritud reaktsioonidele ning hõlmab tavaliselt oksüdatsiooni ja redutseerimist (kuid mitte viimases näites).
Kas CaCO3 kuumutamine CaO ja CO2 moodustamiseks on endotermiline või eksotermiline?
peate soojust andma kaltsiumkarbonaadi lõhustamiseks kaltsiumoksiidiks ja süsinikdioksiid . Igas reaktsioonis, kui selle reaktsiooni läbiviimiseks antakse soojust, nimetatakse sellist reaktsiooni endotermiliseks reaktsiooniks fotosüntees ..
Soovitan:
Kuidas eraldada tahket ainet ja segu?

Kokkuvõte Segusid saab eraldada erinevate tehnikate abil. Kromatograafia hõlmab lahusti eraldamist tahkel söötmel. Destilleerimine kasutab ära keemispunktide erinevusi. Aurustumine eemaldab lahusest vedeliku, mille tulemusena jääb tahke aine. Filtreerimine eraldab erineva suurusega tahked ained
Kuidas muuta tahket ainet vedelikuks?
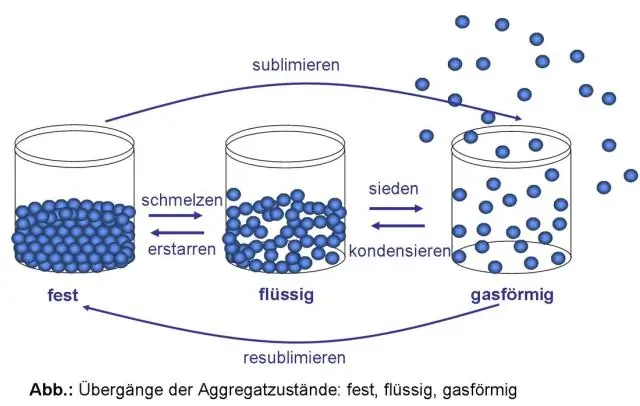
Vedeliku aatomitel on rohkem energiat kui tahke aine aatomitel. Iga aine jaoks on spetsiaalne temperatuur, mida nimetatakse sulamistemperatuuriks. Kui tahke aine saavutab oma sulamistemperatuuri, võib see muutuda vedelikuks
Kui suur on 0,921 mooli gaasilise vääveldioksiidi mass?

Aine koguse SI põhiühik on mool. 1 mool võrdub 1 mooli vääveldioksiidiga ehk 64,0638 grammi
Kui tahket ainet kuumutatakse ja see muutub vedelaks?

Kui jääd (tahke aine) kuumutatakse, muutub see veeks (vedelikuks). Seda muutust nimetatakse SULATAMISEKS. Kui vett kuumutatakse, muutub see auruks (gaasiks). Seda muutust nimetatakse KEEMMISEKS
KClO3 kuumutamisel Kas see laguneb?

KClO3 tugeval kuumutamisel see laguneb, vabastades hapnikku ja jättes maha termiliselt stabiilse (st kuumuse suhtes mittetundliku) ioonse kaaliumiühendi tahke jäägi. Protsessi jaoks on võimalik kirjutada vähemalt kolm usutavat reaktsiooni, kuid ainult üks esineb olulisel määral
