
- Autor Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:35.
- Viimati modifitseeritud 2025-01-22 16:57.
VIDEO
Kuidas siis aatommassi probleeme lahendada?
To arvutama a aatommass elemendi ühe aatomi kohta liidetakse mass prootonitest ja neutronitest. Näide: leidke aatommass süsiniku isotoop, millel on 7 neutronit. Perioodilisest tabelist näete, et süsinikul on an aatomi number 6, mis on selle prootonite arv.
Lisaks, mis on aatommassiarv? The massiarv (sümbol A, saksakeelsest sõnast Atomgewicht [ aatomi kaal]), nimetatakse ka aatommassi number või nukleon number , on kogusumma number prootonite ja neutronite (koos tuntud kui nukleonid) a aatomi tuum. The massiarv on keemilise elemendi iga erineva isotoobi puhul erinev.
Samuti on teada, mis on aatommassi valem?
Keskmine aatommass = f1M1 + f2M2 +… + f M kus f on isotoobi loomulikku arvukust tähistav osa ja M on mass isotoobi arv (kaal). Keskmine aatommass elemendi võib leida perioodilisuse tabelist, tavaliselt elemendi sümboli all.
Mis on keskmine aatommass keemias?
The keskmine aatommass elemendi summa on massid selle isotoopide arvu, millest igaüks korrutatakse selle loodusliku arvukusega (kümnend, mis on seotud protsendiga aatomid selle elemendi kohta, mis on antud isotoobist).
Soovitan:
Kuidas lahendate Hardy Weinbergi probleeme?

VIDEO Lisaks sellele, kuidas leida Hardy Weinbergis P ja Q? Alates lk = 1 - q ja q on teada, on võimalik arvuta lk samuti. Teades p ja q , on nende väärtuste ühendamine süsteemiga lihtne Hardy - Weinberg võrrand (p² + 2pq + q² = 1).
Kuidas arvutate strontsiumi keskmist aatommassi?

Seega arvutame selle, võttes iga isotoobi kaalutud massi ja liites need kokku. Seega korrutame esimese massi puhul 0,50% 84-st (amu - aatommassi ühikud) = 0,042 amu ja lisame selle 9,9% -le 86 amu = 8,51 amu jne
Kuidas arvutate boori aatommassi?
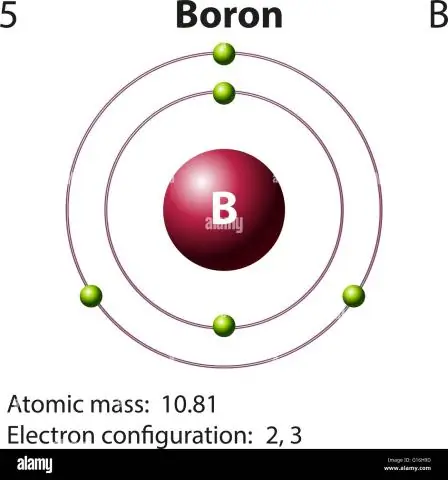
Boori puhul näeb see võrrand välja järgmine: 5 prootonit + 5 neutronit = 10 aatommassiühikut (AMU) või sagedamini esineva boori isotoobi puhul (umbes 5 prootonit + 6 neutronit = 11 AMU)
Kuidas lahendate reagendi massi piiramise probleeme?

Leidke piirav reaktiiv, arvutades ja võrreldes iga reagendi tekitatava produkti kogust. Tasakaalustage keemilise reaktsiooni keemiline võrrand. Teisendage antud teave moolideks. Toodetud toote massi leidmiseks kasutage iga üksiku reagendi jaoks stöhhiomeetriat
Kuidas mõõdetakse aatommassi ühikut?

Aatommassi ühik. Aatommassi ühik (lühendatult: amu, u või Da) on mõõtühik, mida kasutatakse aatomite massi mõõtmiseks. Aatommassi ühik on võrdne 12 süsiniku massist >1⁄12. Sõna "dalton" kasutatakse aja jooksul üha enam
