
Sisukord:
- Autor Miles Stephen stephen@answers-science.com.
- Public 2024-01-18 08:14.
- Viimati modifitseeritud 2025-01-22 16:57.
PH ja pOH määratlus
- Enne pH-taseme arutamist peame mõistma vee tasakaalulist käitumist.
- Kw = [H3O+][OH-] = [H+][OH-] = 1,001 x 10-14 (temperatuuril 25 oC, Kw sõltub temperatuurist)
- Puhtas vees [H+] = [OH-] = 1,00x10-7 M.
- pH on -log[H+] ja pOH lühend -log[OH-].
Veelgi enam, milline on kW valem keemias?
See konstant, Kw , nimetatakse vee autoprotolüüsi konstandiks või vee autoionisatsiooni konstandiks. (Mõnikord jäetakse eesliide auto välja, nagu tehti selle jaotise pealkirjas.) Seda saab määrata katsega ja selle väärtus on 25 °C juures 1,011 x 10¯14. Tavaliselt kasutatakse väärtust 1,0 x 10¯14.
Samamoodi, mis on kW väärtus 25 juures _firxam_#8728; C? The Kw väärtus 25 juures kraadid Celsiuse järgi on konkreetselt 1 × 10-14 1 × 10 - 14. Kw on tasakaalukonstandi näide.
Nii, millega on kW võrdne?
Kilovatt-tund on energia liitühik võrdne üks kilovatt ( kW ) ühe tunni jooksul. Väljendatuna rahvusvahelise ühikusüsteemi (SI) standardses energiaühikus, džaulides (sümbol J), on see võrdne 3600 kilodžauli (3,6 MJ).
Mis on ionisatsioonikonstant?
Meditsiiniline määratlus ionisatsioonikonstant : a konstantne see sõltub tasakaalust ioonide ja molekulide vahel, mis seda ei ole ioniseeritud lahuses või vedelikus -sümbol K. - nimetatakse ka dissotsiatsioonikonstant.
Soovitan:
Kuidas sidemed keemias töötavad?
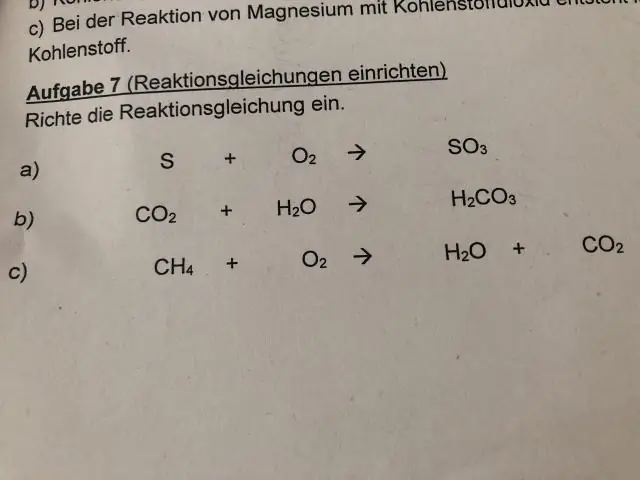
Keemiline side on aatomite, ioonide või molekulide vaheline püsiv külgetõmme, mis võimaldab keemiliste ühendite moodustumist. Side võib tuleneda elektrostaatilisest tõmbejõust vastupidiselt laetud ioonide vahel, nagu ioonsidemete puhul, või elektronide jagamisest nagu kovalentsete sidemete korral
Kuidas kasutate keemias Aufbau põhimõtet?

Aufbau põhimõte kirjeldab reegleid, mida kasutatakse, et määrata kindlaks, kuidas elektronid organiseeruvad aatomituuma ümbritsevateks kestadeks ja alamkesteks. Elektronid lähevad alamkestasse väikseima võimaliku energiaga. Orbitaalil võib olla kuni 2 elektroni, järgides Pauli välistamispõhimõtet
Kuidas arvutatakse keemias EAN-i?

Tavaliselt võrdub tsentraalsete metalliioonide EAN elektronide arvuga lähimas väärisgaasis. Kui keskse metalli EAN on võrdne elektronide arvuga lähimas väärisgaasis, on kompleksil suurem stabiilsus. EAN= [Z metall – (metalli ok. olek) +2 (metalli koordinatsiooninumber)]
Kuidas arvutate entalpia muutust keemias?

Kasuta lahendamiseks valemit ∆H = m x s x ∆T. Kui teil on m, teie reagentide mass, s, teie toote erisoojus ja ∆T, temperatuurimuutus teie reaktsioonist, olete valmis leidma reaktsiooni entalpia. Lihtsalt ühendage oma väärtused valemiga ∆H = m x s x ∆T ja korrutage, et lahendada
Kuidas arvutate lagunemist keemias?

Lagunemisreaktsioon toimub siis, kui üks reagent laguneb kaheks või enamaks tooteks. Seda saab esitada üldvõrrandiga: AB → A + B. Selles võrrandis tähistab AB reaktsiooni alustavat reagenti ning A ja B on reaktsiooni produktid
