
- Autor Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:35.
- Viimati modifitseeritud 2025-01-22 16:57.
Isotoobid on aatomid, millel on sama arv prootoneid, kuid millel on erinev arv neutroneid. Kuna aatomarv on võrdne prootonite arvuga ja aatommass on prootonite ja neutronite summa, siis me saab ütle ka seda isotoobid on elemendid, millel on sama aatomnumber, kuid erinevad massiarvud.
Mis on sellega seoses isotoobid ja näited?
Elemendid määratakse prootonite arvu järgi aatomituumas. Sest näide , 6 prootoniga aatom peab olema süsinik ja 92 prootoniga aatom uraan. Lisaks prootonitele sisaldavad peaaegu iga elemendi aatomid ka neutroneid. Need isotoobid nimetatakse süsinik-12, süsinik-13 ja süsinik-14.
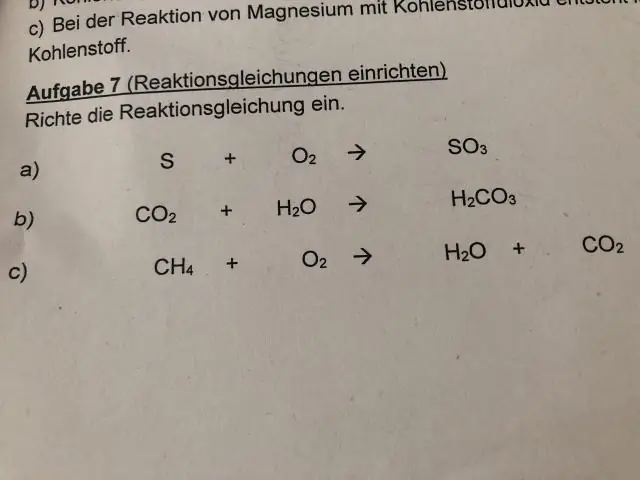
Tea ka, kuidas arvutate isotoope? Massinumbri võib kirjutada ka ülaindeksina elementide sümboli (nt ^235U) ette. Massiarv an isotoop esindab massi isotoobid prootonid ja neutronid. Arvutage neutronite arv an isotoop , lahutades massiarvust aatomarvu.
Samuti on vaja teada, kuidas isotoop moodustub?
Iga erineva neutronite arvuga elemendi kombinatsiooni nimetatakse an isotoop . Isotoobid mis on radioaktiivsed, lagunevad või lagunevad prognoositaval viisil ja kindla kiirusega tegema muud isotoobid . Radioaktiivne isotoop nimetatakse vanemaks ja isotoop lagunemisel tekkinud nimetatakse tütreks.
Mis on isotoobi lihtne määratlus?
isotoop . An isotoop Keemilise elemendi aatom on aatom, millel on selle elemendi standardist erinev neutronite arv (st suurem või väiksem aatommass). Aatomarv on prootonite arv aatomi tuumas.
Soovitan:
Kuidas sidemed keemias töötavad?
Keemiline side on aatomite, ioonide või molekulide vaheline püsiv külgetõmme, mis võimaldab keemiliste ühendite moodustumist. Side võib tuleneda elektrostaatilisest tõmbejõust vastupidiselt laetud ioonide vahel, nagu ioonsidemete puhul, või elektronide jagamisest nagu kovalentsete sidemete korral
Kuidas te isotoope tutvustate?
Isotoobid määratletakse kõigepealt nende elemendi ja seejärel prootonite ja neutronite summa järgi. Süsinik-12 (või 12C) sisaldab kuut prootonit, kuus neutronit ja kuus elektroni; seetõttu on selle massiarv 12 amu (kuus prootonit ja kuus neutronit)
Kas koobaltil on isotoope?

Isotoobid: Koobaltil on 22 isotoopi, mille poolestusaeg on teada, massinumbritega 50 kuni 72. Looduslikult esinev koobalt koosneb selle ühest stabiilsest isotoobist 59Co
Kuidas kasutatakse radioaktiivseid isotoope radiomeetrilises dateerimises?

Radiomeetriline dateering on meetod, mida kasutatakse kivimite ja muude objektide dateerimiseks, mis põhineb radioaktiivsete isotoopide teadaoleval lagunemiskiirusel. Radiosüsiniku dateerimisega näeme, et süsinik-14 laguneb lämmastik-14-ks ja selle poolestusaeg on 5730 aastat
Kas argoonil on isotoope?

Argoonil (18Ar) on 26 teadaolevat isotoopi, 29Ar kuni 54Ar ja 1 isomeer (32mAr), millest kolm on stabiilsed (36Ar, 38Ar ja 40Ar). Maal moodustab 40Ar 99,6% looduslikust argoonist. Kõigi teiste isotoopide poolestusaeg on alla kahe tunni ja enamikul alla ühe minuti
