
- Autor Miles Stephen [email protected].
- Public 2023-12-15 23:35.
- Viimati modifitseeritud 2025-06-01 05:04.
Arrhenius Võrrand : ln k = -Ea/R (1/T)+ ln (A)<----- see on the y = mx + b vorm võrrand aga mul on raskusi selle lahendamise mõistmisega. ln k = -0,0008313/8,314 J/mol K (1/298 K ) + ln (-0,8794) <----nii ma seadsin numbreid, kuid ma ei pea seda õigeks
Mis on Ln K keemias?
lnk = ln (Ae−Ea/RT)= ln A+ ln (e−Ea/RT) lnk = ln A+−EaRT=(−EaR)(1T)+ ln A. mis on sirge võrrand, mille kalle on -Ea /R. See võimaldab lihtsal viisil määrata aktiveerimisenergia väärtuste põhjal k vaadeldakse erinevatel temperatuuridel graafiku abil lnk funktsioonina 1/T.
Veelgi enam, mis on kiiruskonstant k? The kiiruskonstant , k , on proportsionaalsus konstantne mis näitab seost reagentide molaarse kontsentratsiooni ja määra keemilisest reaktsioonist.
Inimesed küsivad ka, mis on aktiveerimisenergia valem?
Aktiveerimisenergia määramine. Pange tähele, et kui Arrheniuse võrrand on ülaltoodud viisil ümber paigutatud, on see lineaarvõrrand kujul y = mx + b; y on ln(k), x on 1/T ja m on -Ea/R. Reaktsiooni aktiveerimisenergiat saab määrata, leides kalle liinist.
Mis on kiiruskonstandi k ühikud?
The ühikut kohta k sõltuvad reaktsiooni järjekorrast, kuid ühikut ei ole kunagi njuutonit meetri kohta. Näiteks esimese järgu reaktsiooni jaoks k on ühikut 1/s ja teist järku reaktsioon, ühikut 1/M.s.
Soovitan:
Kuidas arvutate standardhälbe PMP-st?

PMBOK-is standardhälbe jaoks kasutatav valem on lihtne. See on lihtsalt (P-O)/6. See on pessimistlik aktiivsuse hinnang miinus optimistlik aktiivsuse hinnang jagatud kuuega. Probleem on selles, et see kuju või vorm ei anna mingil juhul standardhälbe mõõtu
Kuidas arvutate Maa ümbermõõtu selle laiuskraadil?

Ringjoone ümbermõõt on 2πr, kus r on selle raadius. Maal on sfääri ümbermõõt antud laiuskraadil 2πr(cos θ), kus θ on laiuskraad ja r on Maa raadius ekvaatoril
Kuidas arvutate sagedust sagedusest ja protsentidest?
Selleks jagage sagedus tulemuste koguarvuga ja korrutage 100-ga. Sel juhul on esimese rea sagedus 1 ja tulemuste koguarv 10. Protsent oleks siis 10,0. Viimane veerg on kumulatiivne protsent
Kuidas arvutate ahela potentsiaalset langust?
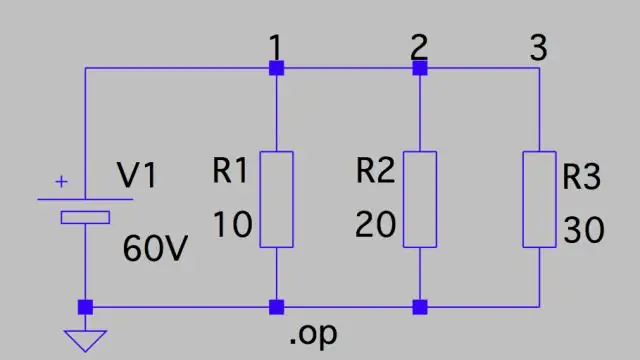
Pingelangus: paralleelne vooluahel See tähendab, et pingelang mõlemal on vaid ahela kogupinge jagatud takistite arvuga ahelas ehk 24 V/3 = 8 V
Kuidas arvutate kloorisisalduse protsenti?

18 neutroniga kloori isotoobi arvukus on 0,7577 ja massiarv 35 amu. Keskmise aatommassi arvutamiseks korrutage see osa iga isotoobi massinumbriga, seejärel lisage need kokku
