
Sisukord:
- Autor Miles Stephen stephen@answers-science.com.
- Public 2024-01-18 08:14.
- Viimati modifitseeritud 2025-01-22 16:57.
Lahuse entalpia (lahuse soojuse) näide
- Arvutama a soojust vabastatud, q, džaulides (J), poolt reaktsioon : q = mass (vesi) × spetsiifiline soojust mahutavus (vesi) × temperatuuri muutus ( lahendus )
- Arvutama lahustunud aine moolid (NaOH(s)): moolid = mass ÷ molaarmass.
- Arvutama a entalpia muutus, ΔH, kJ mol-1 lahustunud ainest:
Samuti, kuidas leida moodustumise soojust?
See võrrand väidab sisuliselt, et standard entalpia muutmine moodustamine on võrdne standardentalpiate summaga moodustamine toodetest miinus standardsete entalpiate summa moodustamine reagentidest. ja standard moodustumise entalpia väärtused: ΔH fo[A] = 433 KJ/mol. ΔH fo[B] = -256 KJ/mol.
Seejärel tekib küsimus, mida tähendab lahustumissoojus? Definitsioon kohta lahuse soojus .: soojust areneb või imendub, kui aine lahustub spetsiifiliselt: kogus, mis tekib siis, kui üks mool või mõnikord üks gramm lahustub suures lahustiliias.
Tea ka, kuidas arvutada soojuse muutust?
Millal soojust ülekandega, kasutage seda valemit: muuta temperatuuril = Q / cm kuni arvutama a muuta temperatuuril teatud kogusest soojust lisatud. Q tähistab soojust lisatud, c on konkreetne soojust kuumutatava aine võimsus ja m on kuumutatava aine mass.
Mida tähendab põlemissoojus?
Põlemissoojus (ΔH°c) on kujul vabanenud energiahulga mõõt soojust (q) kui põletatakse üks mool ainet ( põlemine ). Tootmine soojust tähendab, et reaktsioon on eksotermiline protsess ja eraldab energiat.
Soovitan:
Kuidas lahendate Hardy Weinbergi probleeme?

VIDEO Lisaks sellele, kuidas leida Hardy Weinbergis P ja Q? Alates lk = 1 - q ja q on teada, on võimalik arvuta lk samuti. Teades p ja q , on nende väärtuste ühendamine süsteemiga lihtne Hardy - Weinberg võrrand (p² + 2pq + q² = 1).
Kuidas lahendate ideaalse gaasi seadust?

Ideaalse gaasi seaduse valem Ideaalse gaasi seaduse valemiga seotud küsimused: Vastus: maht on V = 890,0 ml ja temperatuur on T = 21 °C ja rõhk on P = 750 mmHg. PV = nRT. Vastus: Moolide arv on n = 3,00 mooli, temperatuur on T = 24°C ja rõhk P = 762,4 mmHg. PV = nRT
Kuidas lahendate murdude korrutamist ja jagamist?
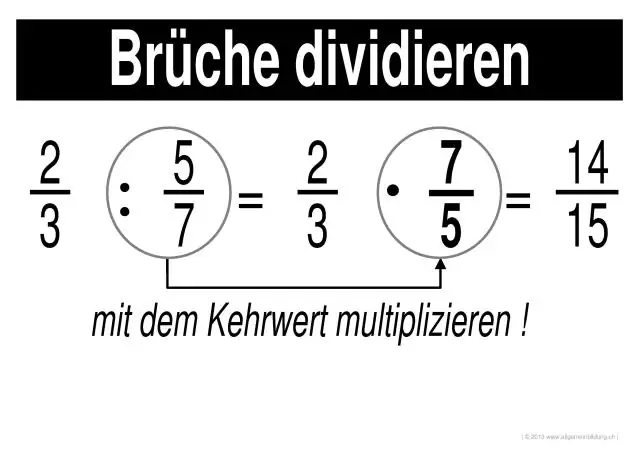
Murdude korrutamine ja jagamine 1. samm: korrutage iga murru lugejad üksteisega (ülemisel olevad numbrid). Tulemuseks on vastuse lugeja. 2. samm: korrutage iga murdosa nimetajad üksteisega (allolevad numbrid). Tulemuseks on vastuse nimetaja. 3. samm: lihtsustage või vähendage vastust
Kuidas lahendate identiteedivara?

Identiteedi omadus koosneb kahest osast: liitidentiteet ja mitmekordne identiteet. Lisage arvule null (0), summa on see arv. Korrutage arv 1-ga, toode on see arv. Jagage arv iseendaga, jagatis on 1
Kuidas lahendate LP-d Excelis graafiliselt?
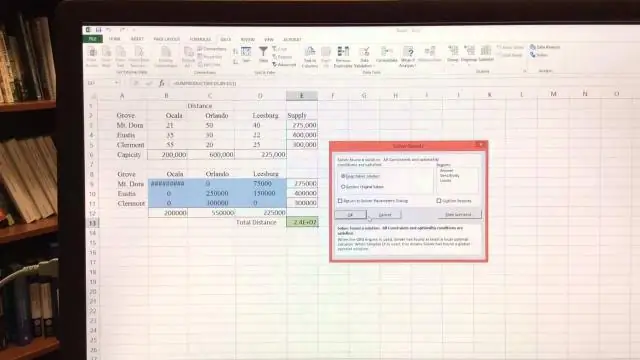
VIDEO Kuidas sel viisil probleemi graafiliselt lahendada? To lahendada võrrand tähendab leida kõik väärtused, mis muudavad väite tõeseks. To lahendada võrrand graafiliselt , joonistage graafik võrrandi iga külje, liikme jaoks ja vaadake, kus kõverad ristuvad, on võrdsed.
