
- Autor Miles Stephen stephen@answers-science.com.
- Public 2024-01-18 08:14.
- Viimati modifitseeritud 2025-01-22 16:57.
Lahuse soojuse või lahuse entalpia keemia õpetus
- Arvutatakse vabanenud või neeldunud energia hulk. q = m × Cg × ΔT. q = vabanenud või neeldunud energia hulk.
- arvutama mooli lahustunud ainet. n = m ÷ M. n = lahustunud aine moolid.
- Energia hulk ( soojust ) vabanenud või neeldunud lahustunud aine mooli kohta arvutatakse. ΔHsoln = q ÷ n.
Lihtsalt nii, kuidas arvutada lahuse soojust kJ mol?
Lahuse entalpia (lahuse soojuse) näide
- Arvutage eralduv soojus q džaulides (J) reaktsiooniga: q = mass (vesi) × erisoojusmaht (vesi) × temperatuuri muutus (lahus)
- Arvutage lahustunud aine (NaOH) moolid(s)): moolid = mass ÷ molaarmass.
- Arvutage entalpia muutus ΔH kJ mol-1 lahustunud ainest:
mis on NaOH lahustumissoojus? Aktsepteeritud väärtus NaOH lahuse soojus on 44,2 kJ/mol ja NH4NO3 puhul 25,4 kJ/mol.
Seejärel võib ka küsida, kuidas neelduvat soojust arvutate?
The soojus neeldub on arvutatud korrutades vee moolid molaariga soojust aurustumisest. 5. Auru kuumutatakse 100oC kuni 140oC. The soojus neeldub on arvutatud kasutades spetsiifilist soojust auru ja võrrand ΔH = cp × m × ΔT.
Mis on NaOH erisoojus?
Minimaalne temperatuur algtemperatuurina = 43,5 °C. HCl tihedus & NaOH Lahus = 1,04 g/ml. Erisoojus HCl ja NaOH Lahus = 4,017 J/g°C.
Soovitan:
Kuidas arvutate standardhälbe PMP-st?

PMBOK-is standardhälbe jaoks kasutatav valem on lihtne. See on lihtsalt (P-O)/6. See on pessimistlik aktiivsuse hinnang miinus optimistlik aktiivsuse hinnang jagatud kuuega. Probleem on selles, et see kuju või vorm ei anna mingil juhul standardhälbe mõõtu
Kuidas arvutate Maa ümbermõõtu selle laiuskraadil?

Ringjoone ümbermõõt on 2πr, kus r on selle raadius. Maal on sfääri ümbermõõt antud laiuskraadil 2πr(cos θ), kus θ on laiuskraad ja r on Maa raadius ekvaatoril
Kuidas arvutate sagedust sagedusest ja protsentidest?
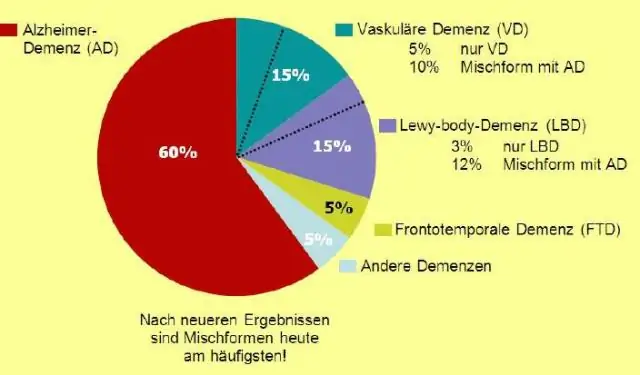
Selleks jagage sagedus tulemuste koguarvuga ja korrutage 100-ga. Sel juhul on esimese rea sagedus 1 ja tulemuste koguarv 10. Protsent oleks siis 10,0. Viimane veerg on kumulatiivne protsent
Kuidas arvutate ahela potentsiaalset langust?
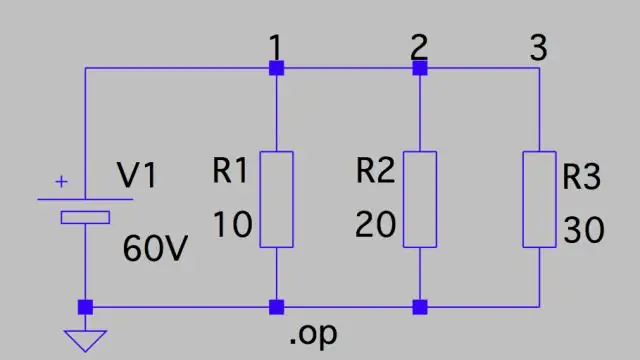
Pingelangus: paralleelne vooluahel See tähendab, et pingelang mõlemal on vaid ahela kogupinge jagatud takistite arvuga ahelas ehk 24 V/3 = 8 V
Kuidas arvutate kloorisisalduse protsenti?

18 neutroniga kloori isotoobi arvukus on 0,7577 ja massiarv 35 amu. Keskmise aatommassi arvutamiseks korrutage see osa iga isotoobi massinumbriga, seejärel lisage need kokku
